流行性感冒是由流行性流感病毒引起的急性呼吸道传染病,主要通过接触及空气飞沫传播,冬夏季高发。2020年4月,疾病预防控制局发布2019年全国法定传染病疫情概况,其中流感报告发病数位居第一,高达350万例,发病率为253/10万,较去年上升359%,呈明显增长[1]。
2018年first-in-class抗流感药物Baloxavir marboxil陆续在多国上市,EvaluatePharma数据库显示,2018年Baloxavir marboxil全球销售额达2.45亿美元。与奥司他韦相比,Baloxavir marboxil具有不需疗程化治疗(奥司他韦连续治疗5天),仅需一天一次给药,疾病症状缓解时间与奥司他韦相比非劣效,病毒滴度和安全性方面优于奥司他韦等优势。这或将打破近20年来神经氨酸酶抑制剂主导流感市场的格局,为流感提供全新的治疗机制,得到业界广泛关注。
Baloxavirmarboxil是由日本盐野义开发的首个新型cap依赖型核酸内切酶抑制剂,经芳基乙酰胺脱乙酰酶(AADAC)代谢产生活性代谢产物Baloxavir acid。盐野义与Roche达成合作协议,Roche拥有除日本和台湾地区以外的商业推广权。
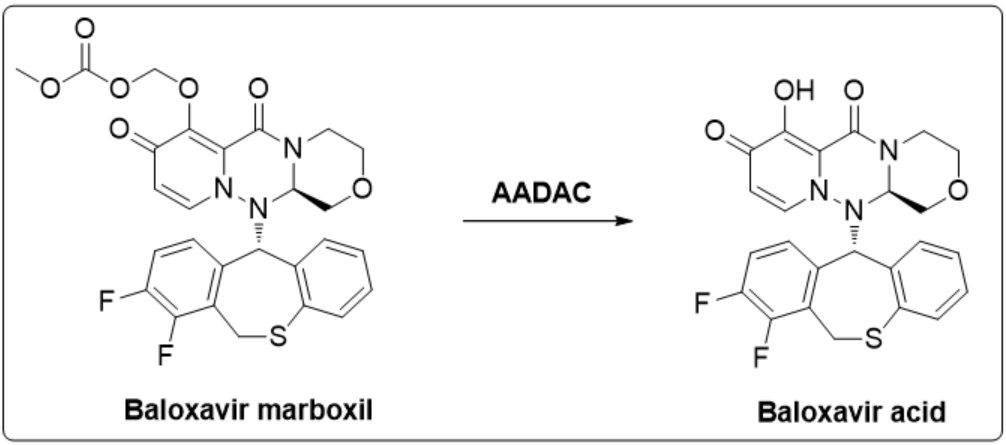
Baloxavirmarboxil共开发了片剂和颗粒剂两种剂型。2018年3月,片剂首次在日本获批上市,用于治疗12岁及以上急性无并发症的流感患者,同年9月颗粒剂在日本获批上市;2018年12月,FDA批准其上市;2019年10月FDA批准其用于治疗12岁以上流感并发症高风险人群;2020年3月,Roche向FDA提交用于1岁以上流感预防的片剂和颗粒剂上市申请以及12岁以下急性并发症流感治疗的上市申请;2020年6月10日,Roche在中国提交的Baloxavir marboxil片上市申请获NMPA受理。
Baloxavirmarboxil开发
由聚合酶酸性蛋白(PA)、碱性聚合酶1(PB1)和2(PB2)组成的流感RNA聚合酶在病毒复制和转录过程中起着至关重要的作用。病毒mRNA转录取决于独特的“抢帽(cap-snatching)”机制[2]:PB2与宿主中5’-cap转录物结合,PA中的cap依赖型核酸内切酶在距5’-cap约12个核苷酸的位置内切,将切下来的cap结构作为引物用于病毒mRNA转录。因此,抑制该核酸内切酶可以抑制mRNA转录,进而抑制病毒复制。
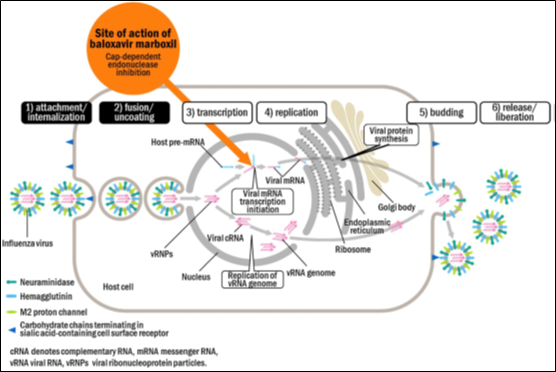
图1. Cap依赖型核酸内切酶抑制剂作用机制[2]
PA蛋白晶体结构披露了CEN活性位点特征,其主要通过2个二价金属离子锰离子发挥作用,随后许多科学家开始设计可以与金属离子配位的结构。盐野义借鉴其早前开发的Dolutegravir,它是通过与2个二价金属离子配位达到抑制HIV-1整合酶的目的[3],差异在于Dolutegravir是与镁离子配位。
盐野义早先设计得到HIV-1整合酶抑制剂单环氨基甲酰基吡啶酮(化合物1),结构中关键药效团3-羟基-4-氧-2-甲酸甲酯与2个镁离子配位,表现出抑制活性,但化合物1在活性和选择性上并不显著。研究表明六元环对于关键药效团空间位置控制上起着重要作用,因此引入双环结构(化合物2)。该化合物对野生型病毒有效,而对突变型病毒无效。进一步对二元环氨基甲酰基吡啶酮进行结构修饰,引入羟基后(化合物3)在突变病毒中活性得到显著改善。但羟基的引入在控制手性和后期构型稳定性上存在问题,因此考虑将羟基束缚在环中提高其构型稳定性,得到三元环氨基甲酰基吡啶酮(化合物4)。确定母核后,对手性和取代基分别进行考察得到Dolutegravir。
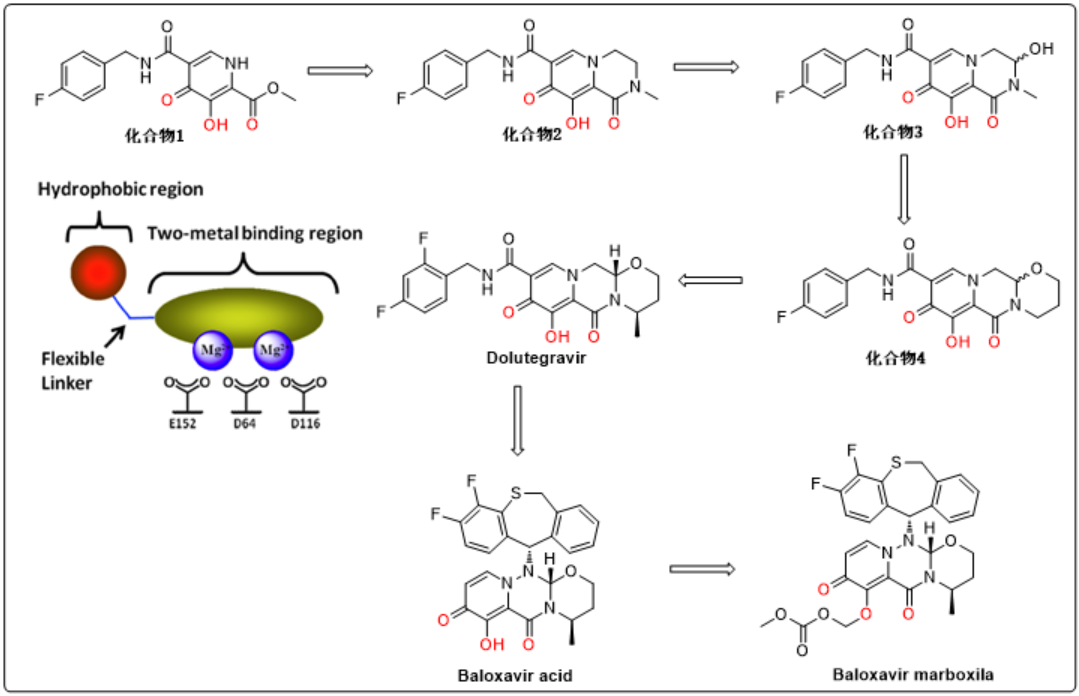
图2. Dolutegravir研发历程和Baloxaviracid衍生[3]
盐野义则根据Dolutegravir设计思路,提取分子中与离子相互作用的关键结构,以其为母核进行结构改造得到Baloxavir acid。Baloxavir acid与CEN蛋白晶体结构显示,Baloxavir acid的7-羟基-6,8-二羰基与2个锰离子形成配位键,进一步确证结构设计合理性。此外,该部分结构还与3个水分子形成氢键,二苯并硫䓬部分则与CEN部分氨基酸残基形成范德华相互作用[4]。但该活性分子在鼠中生物利用度仅有4.2%,对7位羟基进行系列衍生化,最终得到Baloxavir marboxil,生物利用度提高至14.6%,提高了分子在体内的吸收[5]。
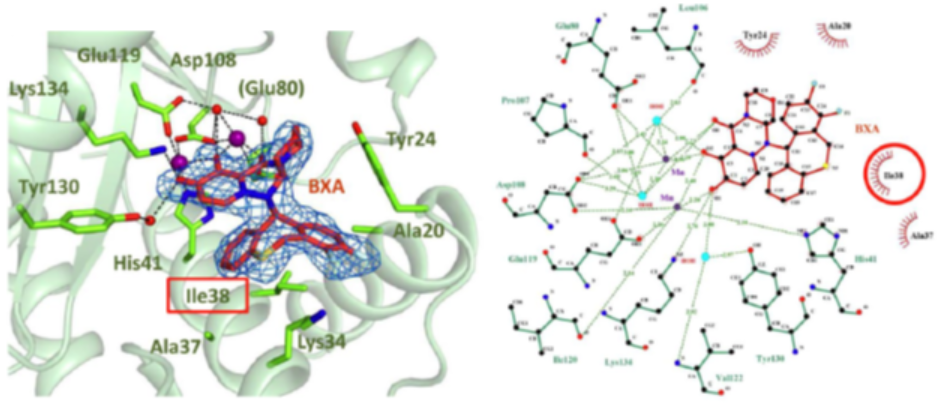
图3. Baloxavir acid与CEN蛋白复合物晶体结构[4]
临床结果
临床III期(CAPSTONE-1)研究是一个随机、双盲、对照试验,招募了12-64岁诊断为流感且流感症状出现不超过48h的患者。20-64岁患者按2:2:1比例随机分组,分别给予单次Baloxavir marboxil(80kg以下患者40mg,80kg以上患者80mg)、连续五天奥司他韦(75mg一天两次)和安慰剂,12-19岁患者按2:1分别给予Baloxavir marboxil和安慰剂。
临床结果显示,Baloxavir marboxil退烧时间(24.5h)较安慰剂短(42.0h),缓解症状时间Baloxavir marboxil与奥司他韦相似(53.5h vs. 53.8h)。此外,与安慰剂和奥司他韦相比,病毒降低幅度更大,治疗24h后,Baloxavir marboxil、奥司他韦和安慰剂较于基线平均病毒滴度分别减少4.4、2.5和1.2 log10TCID50。与安慰剂(96h)和奥司他韦(72h)相比,Baloxavir marboxil显著缩短停止病毒释放时间(24h)。
安全性方面,Baloxavir marboxil不良事件总发生率(20.7%)低于安慰剂(24.6%)和奥司他韦(24.8%),与药物相关的常见不良事件发生率低于奥司他韦(8.4%),与安慰剂相当(4.4% vs. 3.9%)。Baloxavir marboxil常见不良事件为腹泻(3.0%)、支气管炎(2.6%)、鼻咽炎(1.5%)、恶心(1.3%)、鼻窦炎(1.1%)和ALT水平升高(1.0%)[6]。可见,不论在疗效还是安全性方面,Baloxavir marboxil有显著优势。
除此以外,Baloxavir marboxil基于临床III期(CAPSTONE-2)试验结果于2019年10月被FDA批准用于治疗12岁以上流感并发症高风险人群,这也是首个在流感并发症高风险人群中展现出具有临床意义获益的抗病毒药物。CAPSTONE-2临床试验也是随机、双盲、对照试验,招募了12岁以上流感并发症高风险人群[7]。临床结果披露,Baloxavir marboxil改善症状时间(73h)短于安慰剂组(102h),与奥司他韦无统计学差异(81.0h)。Baloxavir marboxil可显著缩短停止病毒释放时间,中位时间为48h,奥司他韦和安慰剂为96h,显著降低流感相关并发症的发生率2.8%,奥司他韦4.6%,安慰剂10.4%。
专利分析和国内企业布局
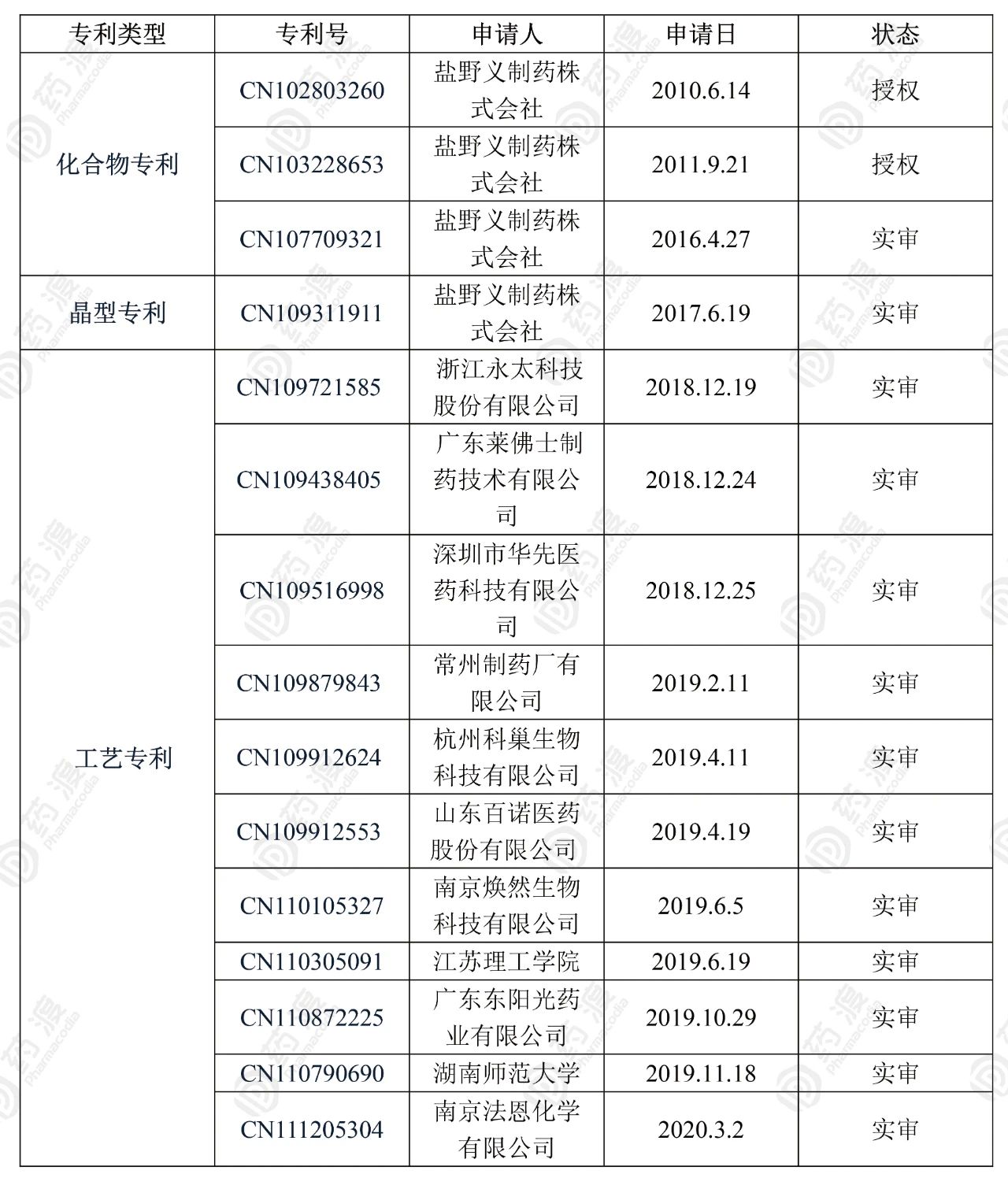
原研公司在国内申请了三个化合物专利和一个晶型专利,两个专利授权,另两个处于实审阶段。其中化合物专利CN102803260对活性代谢产物Baloxavir acid进行了保护,CN103228653专利则对各类衍生前体药物进行保护,但未包含Baloxavir marboxil结构,而CN107709321则对Baloxavir marboxil进行保护,若该专利授权则化合物专利将于2036年到期,晶型专利若授权则对该化合物的保护晚1年。
国内目前有9家药企和2家院校申请了Baloxavir marboxil相关的工艺合成专利,其中包括奥司他韦仿制大户广东东阳光药业。主要可能是由于Baloxavir marboxil分子中存在三个手性中心,对工艺要求较高,因此国内多家企业开始进行工艺优化布局并申请专利保护,从而为后期仿制药成本控制做储备。也间接看出,国内多个企业对该药物的关注和兴趣。
表1. Baloxavir marboxil相关专利
总结
作为近20年首个全新机制的抗流感药物Baloxavir marboxil目前已进入国内上市审评审批,结合其在国内专利申报保护情况,原研药品在国内上市后将独占近15年的市场。期待未来Baloxavir marboxil在国内抗流感市场的表现,新一代抗流感药物是否可突破奥司他韦国内抗流感市场,请我们拭目以待。







