8月6号,葛兰素史克(GlaxoSmithKline, GSK)宣布,美国FDA已批准Blenrep(belantamab mafodotin-blmf)作为单药疗法,用于既往接受过至少4种疗法(包括抗CD38单克隆抗体、蛋白酶体抑制剂和免疫调节剂)的复发性或难治性多发性骨髓瘤成人患者。根据缓解率,该适应症获得加速批准。Blenrep是全球首个获得批准的抗BCMA(B细胞成熟抗原)疗法。
Blenrep的获批,是基于DREAMM-2研究的6个月初步结果,该研究纳入了患有复发性或难治性多发性骨髓瘤的患者,这些患者尽管接受了标准治疗,但病情仍在恶化。在研究中,接受中位既往7线治疗的患者(n=97)中,Blenrep的总缓解率(ORR)为31%(97.5% CI;21-43);6个月分析时尚未达到中位缓解持续时间(DoR),73%的缓解者的DoR等于或大于6个月。

GSK首席科学官兼研发部总裁Hal Barron博士说:“多发性骨髓瘤作为美国第二大常见的血液癌症,是一种无法治愈的疾病。Blenrep是首个获批的抗BCMA疗法,具有改变目前治疗选择有限的复发或难治性骨髓瘤患者治疗方法的潜力。”Blenrep是GSK在2020年的第5个获得批准的重磅药物,涉及癌症、HIV和慢性肾病等重大医疗需求未满足的领域。这一批准标志着GSK的肿瘤药物组合在4个月内获得FDA的第2次批准。
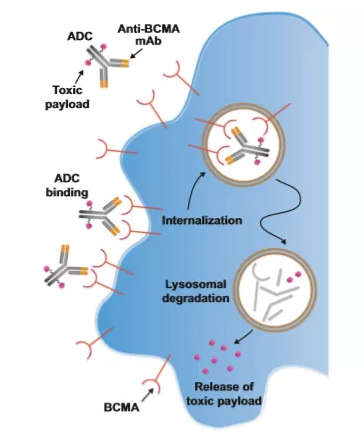
▲靶向BCMA的ADC作用机制(图片来源:参考资料[2])
Blenrep是一种抗体偶联药物,由人源化抗B细胞成熟抗原(BCMA)单克隆抗体和细胞毒药物澳瑞他汀F(auristatin F)通过不可切割的连接子偶联而成。2017年,Blenrep曾获得了FDA的突破性疗法认定。2019年底,GSK向FDA递交该药的生物制品许可申请(BLA),FDA还在随后授予其优先审评资格。今年7月14日,GSK宣布FDA肿瘤学药物咨询委员会(ODAC)以12-0的投票结果支持候选药在治疗复发/难治性多发性骨髓瘤患者时,获益超过风险。值得一提的是,该产品已于今年5月在中国获得临床试验默示许可,适应症为:联合硼替佐米和地塞米松,用于治疗至少接受过一种既往治疗的多发性骨髓瘤成人患者。







