3月18号,国家药监局最新发布了关于发布国家医疗器械监督抽检结果的通告(第1号)(2021年第22号)(以下简称《通告》)。
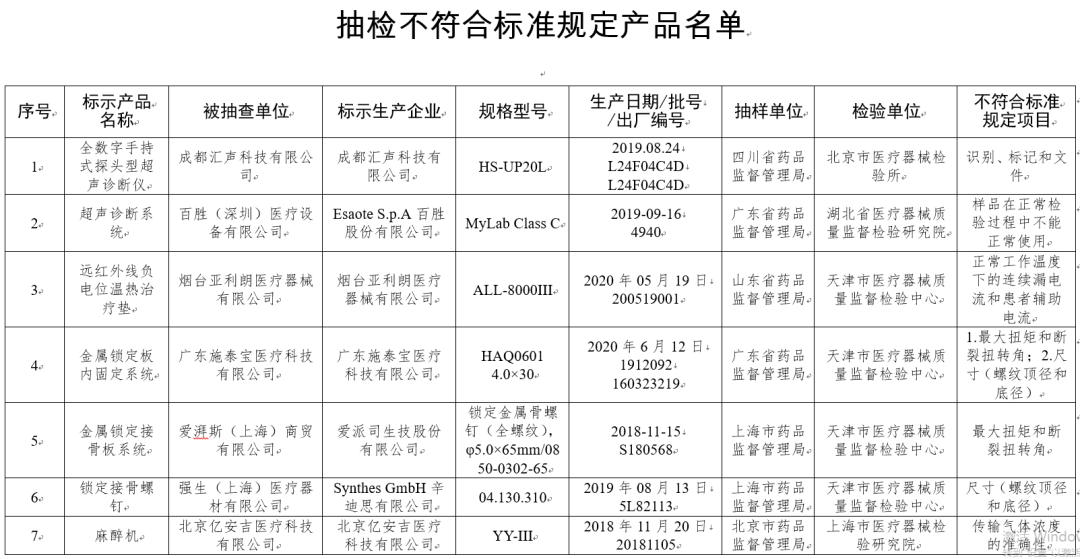
通告显示,国家药品监督管理局组织对电位治疗设备、金属接骨螺钉等14个品种进行了产品质量监督抽检,共33批(台)产品不符合标准规定。
(一)B型超声诊断设备/超声彩色血流成像系统2台:分别为成都汇声科技有限公司、Esaote S.p.A百胜股份有限公司生产,涉及样品在检验过程中不能正常使用、识别、标记和文件不符合标准规定。
(二)电位治疗设备1台:烟台亚利朗医疗器械有限公司生产,涉及正常工作温度下的连续漏电流和患者辅助电流不符合标准规定。
(三)金属接骨螺钉3批次:分别为广东施泰宝医疗科技有限公司、爱派司生技股份有限公司、Synthes GmbH辛迪思有限公司生产,涉及最大扭矩和断裂扭转角、尺寸(螺纹顶径和底径)不符合标准规定。
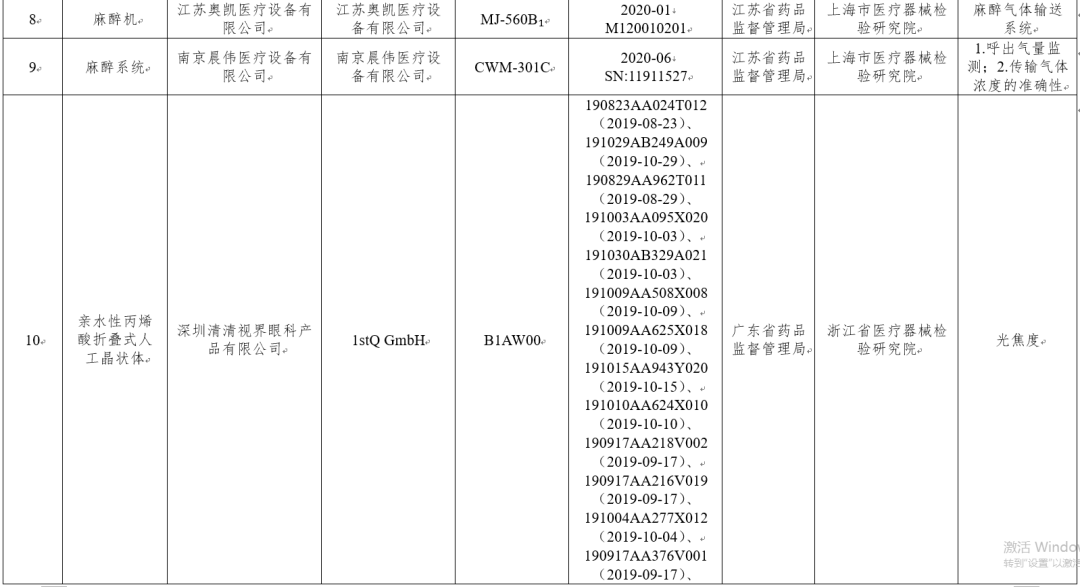
(四)麻醉机(麻醉系统)3台:分别为北京亿安吉医疗科技有限公司、江苏奥凯医疗设备有限公司、南京晨伟医疗设备有限公司生产,涉及传输气体浓度的准确性、麻醉气体输送系统、呼出气量监测不符合标准规定。
(五)人工晶状体1批次:1stQ GmbH生产,涉及光焦度不符合标准规定。
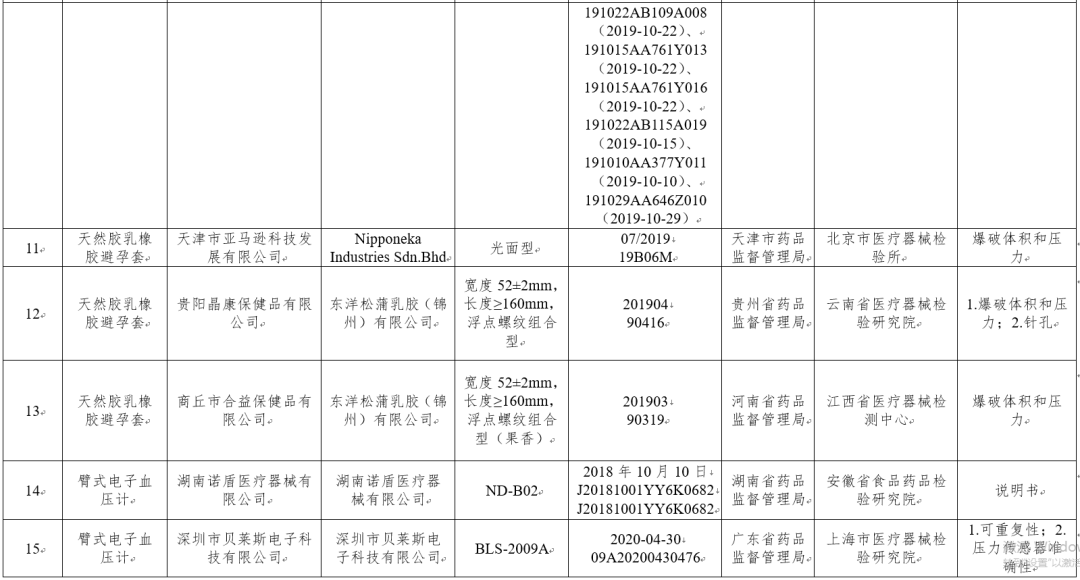
(六)天然胶乳橡胶避孕套3批次:分别为Nipponeka Industries Sdn.Bhd、东洋松蒲乳胶(锦州)有限公司生产,涉及爆破体积和压力、针孔不符合标准规定。
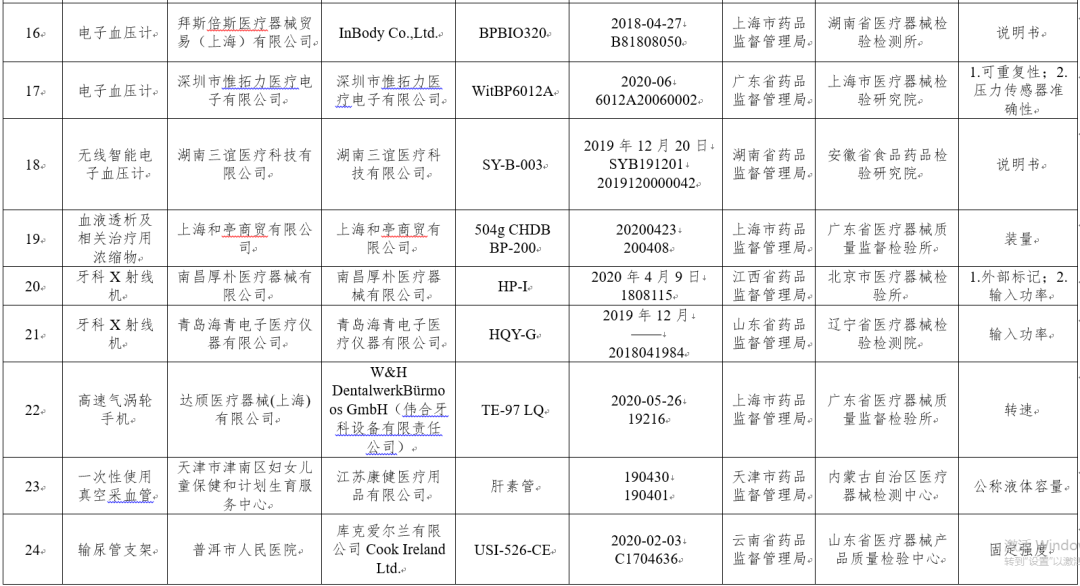
(七)无创自动测量血压计(电子血压计)5台:分别为湖南诺盾医疗器械有限公司、深圳市贝莱斯电子科技有限公司、InBody Co.,Ltd.、深圳市惟拓力医疗电子有限公司、湖南三谊医疗科技有限公司生产,涉及说明书、可重复性、压力传感器准确性不符合标准规定。
(八)血液透析及相关治疗用浓缩物1批次:上海和亭商贸有限公司生产,涉及装量不符合标准规定。
(九)牙科X射线机2台:分别为南昌厚朴医疗器械有限公司、青岛海青电子医疗仪器有限公司生产,涉及外部标记、输入功率不符合标准规定。
(十)牙科手机1台:W&H DentalwerkBürmoos GmbH(伟合牙科设备有限责任公司)生产,涉及转速不符合标准规定。
(十一)一次性使用人体静脉血样采集容器1批次:江苏康健医疗用品有限公司生产,涉及公称液体容量不符合标准规定。
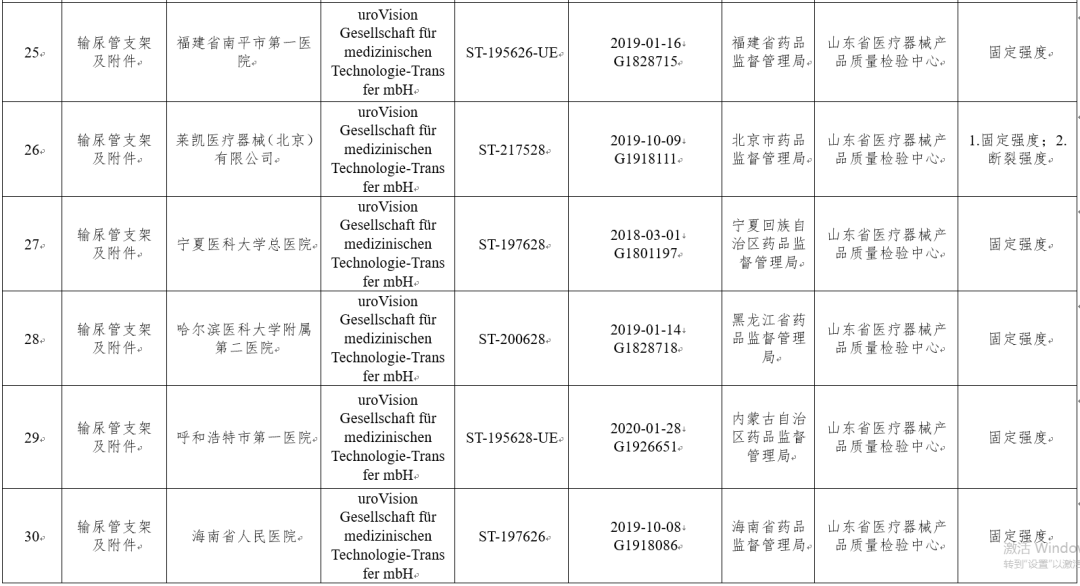
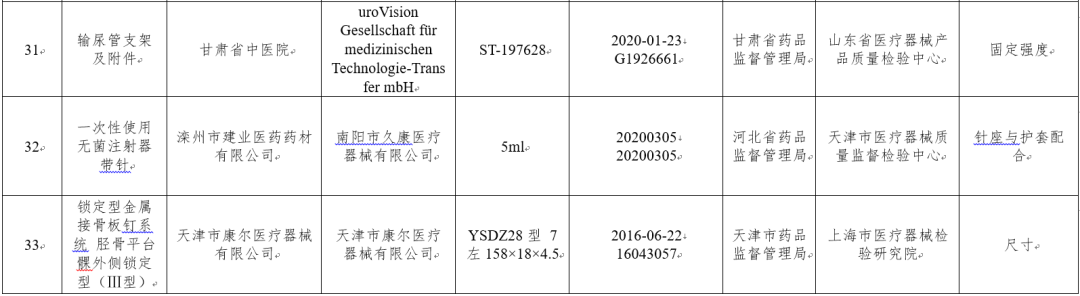
(十二)一次性使用输尿管支架8批次:分别为库克爱尔兰有限公司Cook Ireland Ltd.、uroVision Gesellschaft für medizinischen Technologie-Transfer mbH生产,涉及固定强度、断裂强度不符合标准规定。
(十三)一次性使用无菌注射器1批次:南阳市久康医疗器械有限公司生产,涉及针座与护套配合不符合标准规定。
(十四)金属接骨板1批次:天津市康尔医疗器械有限公司生产,涉及尺寸不符合标准规定。
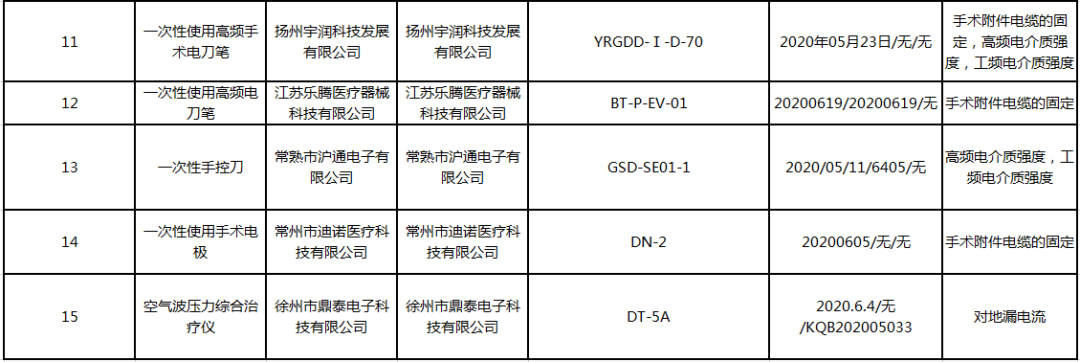
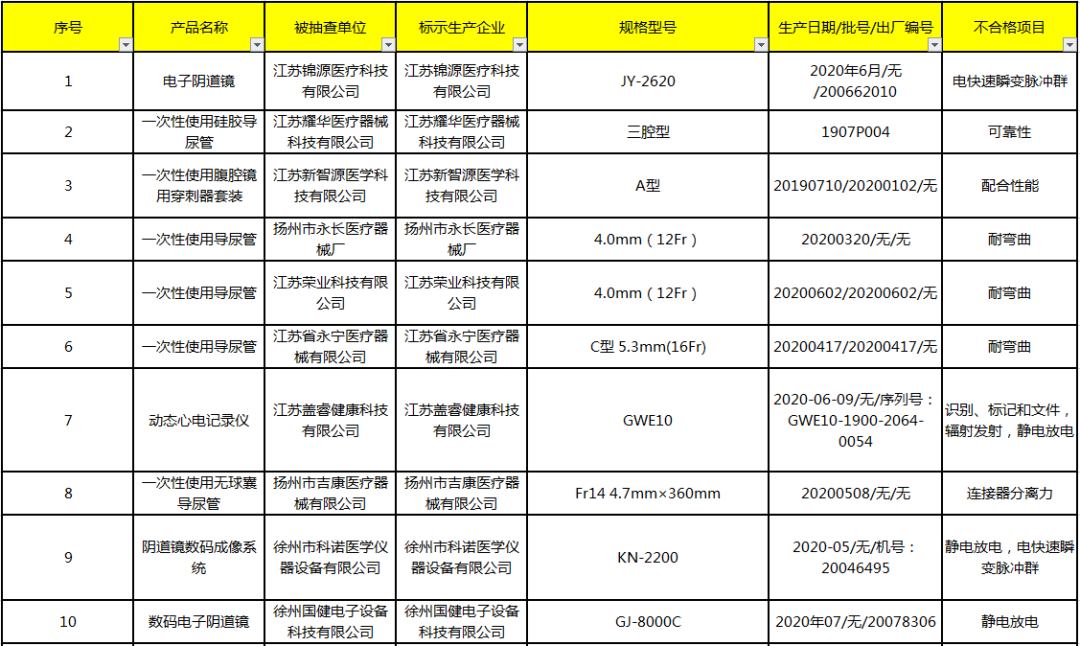
对此,国家药品监督管理局要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。对抽检不符合标准规定的产品进行风险评估,确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。无独有偶,本月9号,江苏省药监局也发布了《关于2020年第2期医疗器械及药品包装材料质量的通告》,经检查发现有15批次医疗器械不合格。主要有电子阴道镜、一次性使用硅胶导尿管、一次性使用腹腔镜用穿刺器套装、一次性使用导尿管、动态心电记录仪、一次性使用无球囊导尿管、阴道镜数码成像系统、数码电子阴道镜、一次性使用高频手术电刀笔、一次性手控刀、一次性使用手术电极、空气波压力综合治疗仪、一次性使用高频电刀笔。像这样的医疗器械抽检行动,近年来出现的越来越密集。对此,国家药监局去年还对医疗器械行业监管标准进行了再次修订,为此后的医疗器械抽检重点进行了明确划分。轻则罚款,重则直接停产整改,在各省医疗器械抽检行动中屡见不鲜。并且,在对违规企业处罚力度不断提升的同时,各地对于医疗器械监督检查的频次更是疯狂增加。近日,中国食品药品网记者采访了国家药品监督管理局医疗器械监督管理司司长王者雄。据了解,2021年我国医疗器械监督工作有这些重点内容值得大家注意!1、各省药监局将组织辖区内第二、三类医疗器械生产企业开展风险隐患排查,在企业自查基础上,组织开展安全风险隐患全面梳理和排查,必要时组织专项检查。
2、国家药监局重点组织对无菌植入性医疗器械、国家集中带量采购医疗器械、创新医疗器械、附条件审批医疗器械等产品,以及多次抽检不合格医疗器械、投诉举报和舆情频发涉及质量问题等产品开展飞行检查。3、继续开展医疗器械“清网”行动,加强网络销售监管,监测网络第三方平台违法违规产品线索,及时进行处置。4、加大案件查办力度,严厉打击无证生产和生产无证产品、不符合强制性标准或产品技术要求等违法违规行为。5、国家药监局将组织对风险高、使用量大、社会关注度高、日常监管工作发现存在问题的60余个品种开展国抽,对国家集中带量采购中选冠脉支架产品开展专项抽检。并且,王者雄还强调各省药监局要结合省抽计划,以生产环节为重点,对辖区内生产经营使用产品开展常规抽检。不难发现,从2021年开始,已有多省发布了关于2021年医疗器械监督检查计划,比如:辽宁省药品监督管理局于2月9日率先公布了2021年度药监检查计划,明确对医疗器械生产经营环节开展检查计划,以飞检为主,11月底前完成。3月16日,宁夏药品监督管理局发布了《关于认真做好2021年全区医疗器械生产企业监督检查工作的通知》。提出对全区范围内所有医疗器械生产企业开展飞检计划。3月11日-17日,山西省药监局更是连发5则关于医疗器械监督检查的信息,从医疗器械生产企业、经营使用单位到临床试验机构,全方位开展监督检查计划。除了以上三个省级文件,包括深圳市、定西市、柳州市、广安市等许多市级药品监督管理局,也都发布了2021年医疗器械监督检查计划。面对如此紧锣密鼓的检查计划,想必不少企业老板已经开始头疼了,但现实的残酷还不仅如此。2021年国家药监局还将继续组织开展国家医疗器械检查员遴选和培训工作,吸纳更多具有丰富实践经验的优秀基层监管人员,带动属地检查员队伍建设,促进各地检查能力不断提升。在信息化建设上,国家药监局和各省药监局还将进行医疗器械行政许可备案、监督检查等相关信息系统功能改造升级。并且,随着新修订的《医疗器械监督管理条例》落地,医疗器械监管力度空前提升。2021年,所有医疗器械相关企业必须时刻谨记,生存的开端从合规合法开始!