一、制定程序的背景
2015年7月31日,省局发布了《辽宁省医疗器械注册质量管理体系核查工作程序(暂行)》,对规范省内医疗器械注册质量管理体系核查工作,推进医疗器械注册管理工作起到了积极作用。2017年,结合省内工作实际情况,为进一步规范医疗器械注册质量管理体系核查工作程序,推动医疗器械产业发展,根据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《境内第三类医疗器械注册质量管理体系核查工作程序(暂行)》(食药监械管〔2015〕63号)等相关规定,2017年7月13日省局发布了《辽宁省医疗器械注册质量管理体系核查工作程序》,同时明确自2017年8月1日起,辽宁省内第二类和第三类医疗器械注册质量管理体系核查工作按此程序执行,2015年7月31日省局发布的《辽宁省医疗器械注册质量管理体系核查工作程序(暂行)》同时废止。
二、制定情况
自2017年初,医疗器械注册质量管理体系核查工作程序的制定按照工作计划,积极推进,稳步实施。2017年5月初稿形成后,先后召开省内相关部门座谈论证会多次,历经十余次修改,于2017年7月13日发布《辽宁省医疗器械注册质量管理体系核查工作程序》。
三、程序主要内容
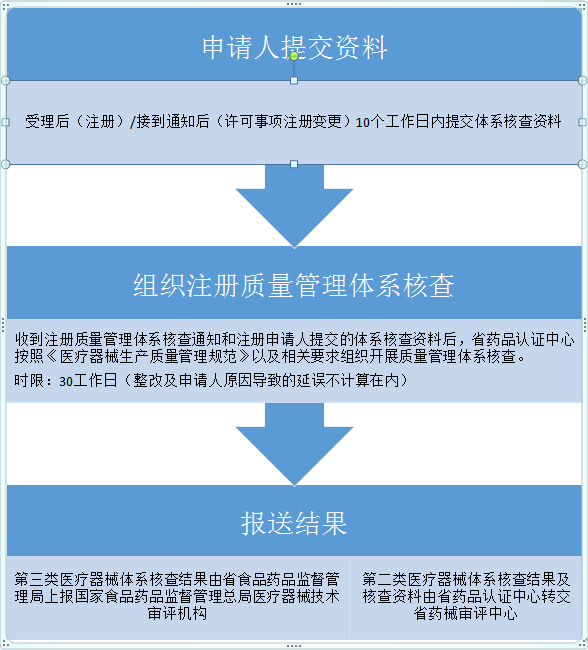
辽宁省医疗器械注册质量管理体系核查工作程序共十七条,包括目的和依据、适用范畴、申请、资料要求、核查程序和核查结论等内容。
(一)核查工作程序的范围
辽宁省内第二类、第三类医疗器械注册质量管理体系核查工作按此程序执行。
(二)核查工作程序
医疗器械注册申请人应当在产品首次注册申请受理后10个工作日内,向辽宁省药品认证中心提交体系核查资料。第二类医疗器械注册变更需要进行体系核查的,通知注册申请人,注册申请人接到辽宁省药械审评与监测中心通知后10个工作日内向省药品认证中心提交体系核查资料。
省药品认证中心收到开展注册质量管理体系核查通知单和注册申请人提交的体系核查资料后,30个工作日内完成注册质量管理体系核查工作。省药品认证中心按照《医疗器械生产质量管理规范》以及相关附录的要求组织开展与产品研制、生产有关的质量管理体系核查。在核查过程中,重点对注册申请人注册检验样品和临床试验用样品的真实性进行核查。主要查阅设计和开发过程实施策划和控制的相关记录、用于样品生产的采购记录、生产记录、检验记录和留样观察记录等。
体系核查完成后,第三类医疗器械体系核查结果由省食品药品监督管理局医疗器械注册处将《境内第三类医疗器械注册质量管理体系核查结果通知》上报国家食品药品监督管理总局医疗器械技术审评机构。第二类医疗器械体系核查结果及核查资料由省药品认证中心转交省药械审评中心。未通过核查的第二类医疗器械,省药械审评中心提出不予注册的审评意见,省食品药品监督管理局作(做)出不予注册的决定。